合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 電噴霧質譜離子源技術優化策略:降低外鞘液表面張力,加速液滴溶劑蒸發
> 4種油醇烷氧基化物平衡和動態表面張力、潤濕性、泡沫性、乳化性質研究(四)
> 4種油醇烷氧基化物平衡和動態表面張力、潤濕性、泡沫性、乳化性質研究(三)
> 4種油醇烷氧基化物平衡和動態表面張力、潤濕性、泡沫性、乳化性質研究(二)
> 4種油醇烷氧基化物平衡和動態表面張力、潤濕性、泡沫性、乳化性質研究(一)
> 納米沸石咪唑酯骨架ZIF-8顆粒的油水界面張力和接觸角測定及巖心驅替實驗——結果與討論、結論
> 納米沸石咪唑酯骨架ZIF-8顆粒的油水界面張力和接觸角測定及巖心驅替實驗——摘要、材料與方法
> 滑溜水壓裂液體系配方
> 彈性薄膜表面張力對由薄膜型聲學超材料隔聲性能的影響
> 水與瓦斯煤之間的表面張力計算方法及動態潤濕機理研究(三)
誘導期測定法研究NaCl的添加對碳酸鋰固-液界面張力等成核動力學參數影響——實驗部分
來源:高等學校化學學報 瀏覽 618 次 發布時間:2025-02-14
摘要
在288.15~323.15 K溫度范圍內,采用誘導期測定法研究了碳酸鋰(Li2CO3)在有無添加NaCl的LiCl-Na2CO3過飽和溶液中的成核動力學.通過OLI電解質與水化學物性分析軟件內嵌的全組分模型嚴格計算Li2CO3在溶液中的過飽和度,研究了溫度、過飽和度和NaCl的添加量對Li2CO3成核誘導期的影響,并結合經典初級成核理論計算了活化能、固-液界面張力和接觸角等成核動力學參數.結果顯示,在相同的過飽和度下,NaCl的添加使得Li2CO3的成核誘導期增長;添加NaCl后Li2CO3成核反應的活化能從63.69 kJ/mol(溶液中Cl?的超額含量Y=0)增加到72.85 kJ/mol(溶液中Cl?的超額含量Y=0.5),表明NaCl的添加抑制了Li2CO3的成核.采用經典初級成核理論研究了Li2CO3的兩種成核機制(均相成核和非均相成核),計算結果表明,在同一溫度下,均相成核時的固-液界面張力始終大于非均相成核時的固-液界面張力,溫度的變化以及NaCl的添加對固-液界面張力的影響均可忽略.
碳酸鋰(Li2CO3)是鋰的基礎產品之一,占鋰總需求量的39%以上[1],被廣泛應用于電池、能源、陶瓷、冶金及醫藥等重要領域[2~4].隨著全球新能源的不斷開發以及儲能鋰電池的高速發展,Li2CO3因其作為鋰電池生產的重要原料而備受矚目[5~7].我國對Li2CO3的需求量逐年快速遞增,預計到2025年會增加到45萬噸左右[8].但是我國鋰原料供應的對外依存度仍高達70%以上[9,10],因此加快推進Li2CO3的工業生產對我國的能源安全具有重要的戰略意義.
我國超過71%的鋰資源賦存于鹽湖鹵水中,而且鹽湖鹵水提鋰具有高純、量大、綠色及經濟的優勢,因此鹽湖鹵水提鋰是目前乃至未來很長一段時間內我國重要的Li2CO3生產渠道[11,12].鹽湖鹵水生產Li2CO3的常用方法是向鹵水LiCl中加入沉淀劑Na2CO3,從而將Li2CO3沉淀結晶出來.在結晶過程中,Li2CO3晶體的成核現象直接影響到其后續的生長過程以及最終晶體產品的質量,因此研究Li2CO3在鹽湖提鋰體系中的成核動力學,可為結晶過程的優化以及結晶器的設計提供重要依據.影響晶體成核的因素有溫度、過飽和度、添加物或雜質的含量等[13,14].由于NaCl是鹽湖鹵水中的主要溶質之一,因此,研究NaCl的添加對Li2CO3成核的影響非常重要.
晶體成核動力學中涉及的一個關鍵參數是成核誘導期(tind),它是將成核理論和實驗研究關聯起來的重要橋梁[15].成核誘導期是指從溶液的過飽和建立到晶核生成所需要的時間[16,17],通常采用實驗方法來測定.目前Li2CO3成核動力學的研究體系包括單一LiHCO3溶液體系和Li2SO4-Na2CO3溶液體系等[13,18],但鮮少有針對鹽湖提鋰體系的研究.此外,由于多元過飽和溶液中離子活度系數的數值很難確定,所以在研究晶體的成核動力學時通常用溶液濃度來估算過飽和度[19],這會導致研究結果出現較大的偏差.而由Marshall Rafal博士創建的OLI電解質與水化學物性分析軟件[20]集理論模型、數據庫、數據回歸和應用為一體,其內嵌的基于全組分的模型能完整嚴格地計算多組分溶液體系中的熱力學數據.
本文研究了Li2CO3在有無添加NaCl的LiCl-Na2CO3過飽和溶液中的成核動力學,其中,溫度范圍為288.15~323.15 K,過飽和度范圍為5.76~31.73.采用具有良好穩定性和靈敏度的激光在線法[21]測量了Li2CO3的成核誘導期.溶液中Li2CO3的過飽和度由OLI電解質與水化學物性分析軟件[20]內嵌的全組分熱力學模型嚴格計算,其中,溶液中離子的活度系數由嵌入的Bromley-Zemaitis方程[22,23]來計算,熱力學平衡常數由嵌入的HKF模型[24~26]來計算.系統考察了過飽和度、溫度以及NaCl的添加對Li2CO3成核動力學的影響,并結合經典初級成核理論計算了活化能、固-液界面張力和接觸角等成核動力學參數.
1實驗部分
1.1試劑與儀器
LiCl·H2O(純度≥99%)、Na2CO3(純度≥99.8%)和NaCl(純度≥99.5%),分析純,國藥集團化學試劑有限公司;去離子水(電導率<0.1μS/cm).
超微量分析天平(精確度±0.0001 g),芬蘭Kibron公司;84-1A型磁力攪拌器,上海司樂儀器有限公司;激光在線監測裝置,北京市東西分析儀器有限公司.
1.2實驗過程
成核誘導期測定實驗在一個通有循環水的玻璃夾套反應釜(容積為150 mL)中進行,釜內溶液濁度的變化通過一套激光在線裝置來監測,實驗裝置見Scheme 1.將50 mL濃度為1.352~3.088 mol/L的LiCl溶液置于反應釜中,使用循環水將溶液溫度升高或降低到某一數值.開啟磁力攪拌器和激光在線監測裝置,待溶液溫度及激光數據采集器數值恒定后,將50 mL相同溫度的Na2CO3溶液迅速加入LiCl溶液中并記錄時間.激光采集器數值先是恒定一段時間不變,然后開始降低;緊接著可以觀察到溶液變渾濁(Li2CO3晶核生成),而且隨激光強度數值的降低越來越渾濁;當激光強度的數值不再變化時,結束實驗.所記錄的激光強度數值恒定不變的時間段即為Li2CO3的成核誘導期.在以上實驗中,LiCl溶液的濃度均為Na2CO3溶液濃度的2倍.
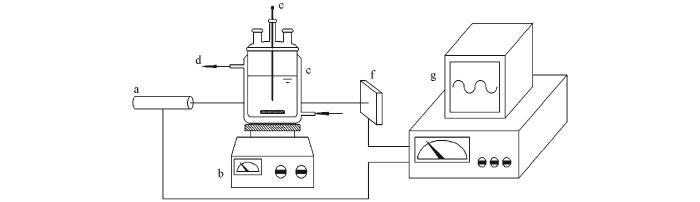
a. Laser generator; b. magnetic stirrer; c. jacketed reactor; d. circulating water; e. thermometer; f. laser detector; g. data acquisition.
在研究NaCl添加量對成核誘導期的影響實驗中,將Na2CO3溶液加入反應釜以前要先加入一定質量的NaCl固體,其余的實驗步驟同上.為了便于計算,將Cl?的超額含量定義如下[27]:
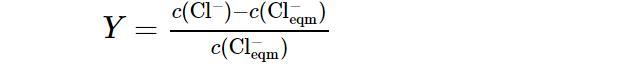
式中:c(Cl?)(mol/L)為溶液中Cl?的總摩爾濃度;c(Cl?eqm)(mol/L)為由于NaCl的加入而增加的Cl?的摩爾濃度.每組實驗均在Cl?的超額含量Y=0.5的條件下進行.










